【摘要】AI医疗正从影像诊断的单点突破,系统性地迈向以虚拟健康助手为入口、精准医疗为目标的生态整合新阶段。
引言
人工智能在医疗健康领域的渗透,早已不是新闻。从实验室的前沿探索到临床应用的逐步落地,这项技术正以前所未有的深度和广度重塑着整个产业。近年来,伴随大模型与生成式AI的浪潮,市场热度持续升温,资本与创新资源加速涌入。据甲子光年预测,中国AI医疗市场规模在2025年将触及1157亿元,并在2028年攀升至1598亿元。
在这样一片繁荣的景象之下,一个更为关键的问题浮出水面,行业在经历了初期的场景验证和商业化探索后,其演进的下一站究竟在何方?为了厘清这一路径,英伟达近期发布了一份基于600余位全产业链专业人士的深度调研报告——《医疗健康和生命科学领域 AI 现状及 2025 年趋势》。这份报告的数据来源覆盖了医疗技术、数字健康、制药生物技术及方案购买方等多个维度,受访者身份横跨企业高管、临床医生与学术研究人员,其结论为我们描绘了一幅关于AI医疗未来发展的清晰蓝图。
本文将基于这份报告的核心洞察,结合产业现状,深度剖析AI医疗从当前的应用格局,到未来三至五年的核心演进方向,并探讨其背后所面临的技术瓶颈与破局之道。
🔬 一、 现状剖析:AI医疗的“压舱石”与价值锚点
%20拷贝.jpg)
任何技术的规模化应用,都需要找到坚实的价值锚点。在AI医疗领域,经过多年的实践与筛选,产业已经清晰地识别出现阶段最具落地性的三大应用场景。这些场景不仅是技术验证的试验田,更是商业模式得以成立的“压舱石”。
1.1 三大核心用例的价值共识
根据英伟达的调研数据,医疗影像和诊断、临床决策支持、疾病诊断和风险预测构成了当前AI医疗应用的三驾马车。其中,医疗影像和诊断以47%的占比位居榜首,紧随其后的是临床决策支持(43%)和疾病诊断和风险预测(40%)。
这三个方向能够脱颖而出,其底层逻辑在于它们共同指向了医疗体系中最核心、最迫切的痛点,即优质医疗资源的稀缺性与分布不均。AI在这些场景中的应用,并非天马行空的创造,而是针对现有流程的精准赋能,其价值主张清晰且可量化。
效率提升:AI能够自动化处理海量、重复性的数据分析工作,例如阅片、病历结构化等,将医生从繁重的劳动中解放出来。
精度保障:算法模型通过对海量数据的学习,能够识别出人眼难以察觉的细微特征,辅助医生降低漏诊率和误诊率。
能力下沉:标准化的AI辅助诊断工具,能够将顶级专家的知识与经验赋能给基层医生,有效弥合不同层级医疗机构间的诊疗水平差距。
1.2 影像诊断的长期优势:供需、流程与商业化的完美契合
医疗影像诊断能够长期占据AI应用的主导地位,并非偶然。它是在供需矛盾、流程刚需与商业化可行性三个维度上找到了最佳平衡点的结果。
1.2.1 尖锐的供需矛盾
影像科医生的短缺是一个全球性难题。根据《中国卫生健康统计年鉴2022》的数据,2021年中国影像科医生配置仅为0.17人/千人,远低于发达国家水平。医生资源的严重不足,叠加日益增长的影像检查需求,形成了一个巨大的效率缺口。AI辅助诊断系统恰好能成为医生的“第二双眼”和“超级助手”,直接缓解这一供需矛盾。
1.2.2 清晰的流程嵌入点
与其他临床环节相比,影像诊断的工作流程相对标准化。从影像采集、处理、阅片到报告撰写,每个环节都有明确的输入和输出。这为AI产品的集成提供了天然的便利。AI模型可以作为一个功能模块,无缝嵌入到医院现有的PACS(影像归档和通信系统)或RIS(放射科信息系统)中,对医生工作流程的扰动最小,从而降低了推广和使用的门槛。
1.2.3 可复制的商业模式
影像诊断AI产品的价值易于衡量,例如节约的阅片时间、提升的病灶检出率等,这为其商业化定价提供了依据。同时,其产品形态也更容易通过医疗器械注册证(如NMPA三类证)的审批路径,获得合规的市场准入身份。截至2024年5月,我国已有85款AI医疗影像产品获批三类证,覆盖了从眼底、肺部到心血管等多个病种,这标志着其商业化路径已经完全跑通。
1.3 成功场景的共性:数据基础与价值闭环
总结来看,当前成功的AI医疗应用场景普遍具备两个核心特征。
相对标准化的数据基础:医疗影像数据(如CT、MRI)的格式相对统一(DICOM标准),标注任务也相对明确(如病灶圈定、良恶性判断),这为模型训练提供了高质量的“燃料”。
可量化的价值闭环:这些应用能够直接作用于临床的核心工作流,其带来的效率和质量提升可以被直观地测量和感知,从而更容易被医疗机构和支付方所接受,形成从技术投入到临床获益再到商业回报的良性循环。
🧭 二、 未来航向:三大引擎驱动下一轮变革
如果说现阶段的成功应用是AI医疗的“基本盘”,那么未来三至五年的发展则将由三大核心引擎驱动,推动产业从单点优化走向系统性变革。调研数据显示,受访者认为未来5年受AI影响最大的三个领域分别是先进医疗影像和诊断(51%)、虚拟医疗健康助手(34%)和精准医疗(29%)。
这三个方向代表了AI医疗演进的三个层次,从现有优势领域的深化,到服务模式的创新,再到终极治疗范式的探索。
2.1 引擎一:先进医疗影像和诊断的深度进化
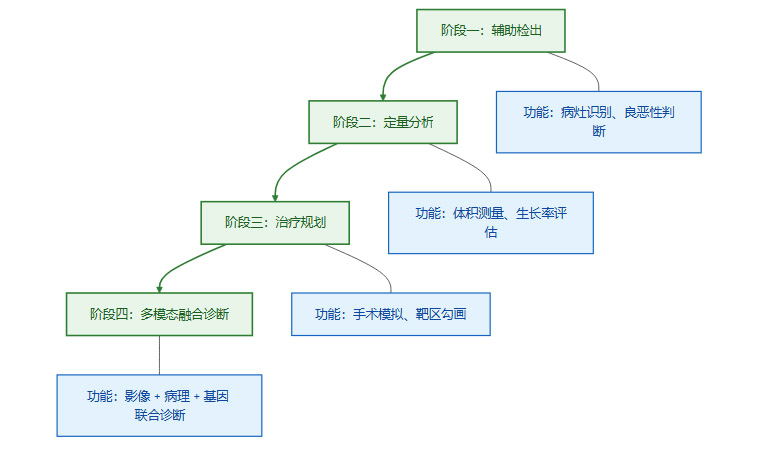
作为存量市场的优势领域,影像诊断的未来发展并非简单的场景复制,而是向着更深、更广的维度进行能力进化。其核心趋势是从“辅助检出”的单一功能,向覆盖诊疗全流程的综合性解决方案演进。
2.1.1 从“定性”到“定量”
当前的AI影像产品大多停留在“定性”分析层面,即判断“有或无”(例如是否存在结节)。未来的进化方向是实现“定量”分析,对病灶的大小、密度、体积、生长速度等进行精准测量和追踪。这对于疾病的分型分期、疗效评估和预后判断具有至关重要的临床价值。
2.1.2 从“诊断”到“治疗规划”
影像数据不仅用于诊断,更是外科手术、放疗等治疗方案制定的基础。AI将越来越多地参与到三维重建、靶区勾画、手术路径规划等环节。例如,在肿瘤放疗中,AI可以自动勾画肿瘤靶区和需要保护的危及器官,大幅提升规划效率和一致性。
2.1.3 从“单模态”到“多模态”
临床诊断往往需要综合多种信息。未来的影像AI将不再局限于单一的影像数据,而是深度融合病理、基因组学、临床检验、电子病历等多源数据。通过多模态数据模型,AI能够提供更为全面和精准的诊断意见,更接近于资深临床专家的综合判断能力。
下面是一个简化的Mermaid流程图,展示了先进医疗影像诊断的演进路径:
2.2 引擎二:虚拟健康助手的崛起
如果说影像AI的主战场在“院内”,那么虚拟医疗健康助手(Virtual Health Assistant, VHA)则正在开辟一个广阔的“院外”新战场。它被视为连接海量用户、沉淀健康数据、整合医疗服务的关键入口。
2.2.1 角色定位:从“问答工具”到“健康管理中枢”
早期的虚拟助手多以智能问诊、健康知识问答等轻量级功能为主。随着大模型在多轮对话、长期记忆、意图理解和任务执行等能力的突破,VHA正在从一个被动的问答工具,升级为一个主动的、全生命周期的健康管理中枢。
它的核心价值不再局限于单次咨询,而是通过与用户的长期、连续互动,实现以下目标:
前端入口:承担健康咨询、智能分诊、用药提醒、复诊预约等任务,成为用户获取医疗服务的第一触点。
数据门户:持续沉淀用户的日常健康数据(如可穿戴设备数据)、生活方式数据、用药行为数据和症状变化记录,形成宝贵的个人健康档案。
服务枢纽:基于积累的数据,连接和调度后续的医、药、险、械等服务资源,实现个性化的慢病管理、康复指导和保险产品推荐。
2.2.2 市场格局与差异化竞争
目前,从互联网巨头(如蚂蚁集团、京东健康)到AI技术厂商(如讯飞医疗),再到垂直领域的患者管理平台,众多玩家已纷纷布局VHA赛道。市场竞争的焦点也逐渐从基础的问答能力,转向差异化的服务闭环和生态整合能力。
未来,VHA的竞争壁垒将建立在个性化、长期记忆、任务执行与服务闭环这四个维度之上。谁能更好地理解用户、记住用户,并为其提供无缝、高效的整合式服务,谁就能在这场“院外入口”争夺战中胜出。
2.3 引擎三:精准医疗的加速
精准医疗是现代医学发展的终极目标之一,旨在根据患者的个体特征(基因、环境、生活方式等)来制定最佳的治疗和预防方案。AI的出现,为这一宏大目标的实现提供了前所未有的技术驱动力。
2.3.1 核心挑战:多源异构数据的融合
精准医疗的最大挑战在于如何处理和理解海量的、多源异构的数据。一个患者的完整画像,可能包含以下多种数据类型:
影像数据:CT、MRI、PET等。
病理数据:数字病理切片图像。
组学数据:基因组、转录组、蛋白质组等。
临床数据:电子病历、检验结果、生命体征。
行为数据:院外监测数据、生活习惯记录。
这些数据维度高、噪声大、格式不一,单纯依靠人力进行分析几乎是不可能的。AI,特别是深度学习模型,擅长从高维复杂数据中自动学习和提取特征,是解决这一多模态数据融合难题的关键技术。
2.3.2 AI的应用路径:从辅助决策到新药研发
在精准医疗领域,AI的应用贯穿了从诊断到治疗再到药物研发的全链条。
疾病精准分型:通过融合多模态数据,AI可以对肿瘤等复杂疾病进行更精细的分子分型,从而匹配更有效的靶向药物或免疫疗法。
治疗方案推荐:模型可以基于患者的个体数据,预测不同治疗方案(如化疗方案、靶向药组合)的疗效和副作用风险,辅助医生制定最优决策。
生物标志物发现:AI能够从海量的组学数据中,高效地筛选和发现与疾病发生、发展或药物反应相关的生物标志物(Biomarker),加速新药研发和伴随诊断的开发。
药物研发加速:在药物发现阶段,AI可以用于靶点发现、化合物筛选和分子设计;在临床试验阶段,AI可以用于患者招募、试验设计优化和数据分析,全方位提升新药研发的效率和成功率。
精准医疗的实现,关键不在于单一模型的性能,而在于能否构建一个数据可信、模型可解释、结果可验证的完整证据链,以支撑高风险的临床决策。
🚧 三、 瓶颈与挑战:横亘在理想与现实之间的鸿沟
%20拷贝.jpg)
尽管AI医疗的未来图景令人振奋,但在从技术愿景走向规模化临床应用的道路上,依然横亘着几道难以逾越的鸿沟。这些挑战不仅是技术层面的,更涉及到数据治理、工程实践、法规监管等多个维度。
3.1 挑战一:数据——永远的“阿喀琉斯之踵”
在所有挑战中,数据问题始终是制约AI医疗发展的核心瓶颈。调研中,33%的受访者将其列为最大的挑战。这不仅仅是“数据量不足”的浅层问题,而是一个涉及隐私、合规、质量和可用性的复杂系统性难题。
3.1.1 隐私合规的“紧箍咒”
医疗数据是个人最敏感的隐私信息之一,受到《网络安全法》、《数据安全法》、《个人信息保护法》等法律法规的严格监管。数据的采集、存储、使用和共享都必须在极其严苛的合规框架下进行。这导致了“数据孤岛”现象的普遍存在,跨机构的数据合作与共享极为困难,极大地限制了模型训练所需数据的规模和多样性。
3.1.2 可用性与标准化的“沼泽”
即便在机构内部,能够直接用于模型训练的高质量数据也凤毛麟角。医疗数据普遍存在以下问题:
异构与碎片化:不同医院、不同科室、不同信息系统(HIS, EMR, LIS, PACS)产生的数据格式、术语、编码标准各不相同,数据清洗和整合的工作量巨大。
标注成本高昂:高质量的医学数据标注需要具备专业知识的临床医生投入大量时间,成本高昂且周期漫长,是AI项目中最耗费资源的环节之一。
数据偏倚与泛化难题:单一医疗机构的数据往往存在人群、设备、地域等方面的偏倚,基于这些数据训练出的模型,在应用到其他场景时,性能可能会出现断崖式下跌,即泛化能力不足。
3.1.3 评测数据的稀缺
除了训练数据,用于模型性能验证和评测的高质量、经“金标准”验证的独立测试集同样稀缺。这使得对模型真实临床性能的客观评估变得非常困难,也为产品的监管审批和临床采信带来了挑战。
3.2 挑战二:工程化落地——从“能跑”到“好用”的“死亡谷”
一个在实验室里表现优异的AI模型,与一个能够在复杂的临床环境中稳定、高效运行的产品之间,隔着一条巨大的“死亡谷”。预算不足(30%)和工程化落地困难是企业面临的第二道严峻门槛。
3.2.1 成本的三座大山
医疗AI的部署和运维面临着高昂的成本压力:
算力成本:无论是模型训练还是推理部署,都需要强大的计算资源,特别是对于大模型而言,其硬件投入和电费消耗都是一笔不小的开支。
集成成本:将AI产品无缝对接到医院现有的、通常是陈旧而复杂的信息系统中,需要大量的定制开发和联调测试工作,成本高昂且耗时。
运维成本:模型部署后,需要持续的监控、维护和迭代,以应对数据漂移、系统更新等问题,确保其性能的稳定性和可靠性。
3.2.2 从POC到规模化部署的鸿沟
许多AI项目能够成功完成概念验证(Proof of Concept, POC),但在尝试进行全院或多中心规模化部署时却举步维艰。这其中的原因复杂多样,包括但不限于:
临床工作流的摩擦:产品设计未能充分贴合医生的实际工作习惯,增加了额外操作负担,导致医生使用意愿不高。
IT基础设施的限制:医院的网络带宽、服务器性能、存储容量等可能无法满足AI系统大规模运行的要求。
验证周期的漫长:在临床环境中对AI产品的有效性和安全性进行充分验证,需要一个漫长且严谨的过程,这考验着企业的耐心和资金实力。
3.3 挑战三:信任与合规——通往临床采信的“最后一公里”
技术最终要服务于人。在医疗这个高风险领域,获得临床医生的信任是AI产品成功的终极前提。
3.3.1 “黑箱”问题与可解释性
许多深度学习模型,特别是复杂的模型,其决策过程如同一个“黑箱”,难以向医生解释其做出某一判断的具体依据。这种可解释性(Explainability)的缺乏,会严重影响医生对AI结论的采信度。当AI的建议与医生的判断相悖时,医生很难在不理解其推理过程的情况下,采纳AI的意见。
3.3.2 评测体系与监管适配
如何科学、客观地评价一个医疗AI产品的临床价值,目前仍缺乏统一、公认的标准和评测体系。同时,随着技术的快速迭代,现有的医疗器械监管法规如何适配AI产品的特性(如持续学习、自适应能力),也是监管机构和产业界共同面临的课题。产品的合规路径和审批周期,直接关系到其商业化的生死存亡。
🛠️ 四、 破局之道:技术栈、生态与范式迁移
%20拷贝.jpg)
面对上述重重挑战,产业界并未坐以待毙,而是正在从技术栈、生态合作和开发范式等多个层面积极寻求破局之道。以英伟达为代表的基础设施提供商,其策略正在从单纯提供硬件算力,转向构建一个“平台化工具链 + 合成数据 + 仿真/数字孪生”的综合性赋能体系。
4.1 路径一:平台化工具链降低开发门槛
为了应对高昂的开发成本和漫长的研发周期,提供领域专用、端到端的开发平台成为主流趋势。英伟达的NVIDIA Clara平台就是一个典型例子,它并非一个单一产品,而是一个包含了多个针对医疗健康领域特定任务的软件开发套件(SDK)和微服务的集合。
这种平台化的方式,通过提供预训练模型、标准化的开发组件和优化的计算库,极大地降低了医疗AI应用的开发门槛,使开发者能够将更多精力聚焦于解决临床问题本身,而非底层的技术实现。
4.2 路径二:合成数据与数字孪生破解数据困境
针对最棘手的数据难题,合成数据(Synthetic Data)和数字孪生(Digital Twin)技术正展现出巨大的潜力,成为一种绕开现实世界数据限制的创新范式。
4.2.1 合成数据:高质量“燃料”的制造工厂
合成数据是通过计算机模型生成的人工数据,其在统计学特性上与真实数据高度相似,但又不包含任何真实的个人信息,从而天然地规避了隐私合规风险。
解决数据稀缺:对于罕见病等难以获取大量真实数据的场景,可以生成海量的合成数据用于模型训练。
增强数据多样性:可以按需生成特定特征(如不同年龄、性别、病灶形态)的数据,以弥补真实数据集的偏倚,提升模型的泛化能力。
降低标注成本:合成数据在生成时可以自带完美的像素级标注,省去了昂贵的人工标注环节。
4.2.2 数字孪生:虚拟世界中的“试验场”
数字孪生技术通过在虚拟空间中创建一个与物理实体(如手术机器人、医疗设备、甚至人体器官)精准对应的数字化模型,为AI的开发、测试和验证提供了一个低成本、高效率、零风险的“试验场”。
英伟达的NVIDIA Omniverse平台,正是构建这种高保真数字孪生的基础。在此之上,NVIDIA Isaac for Healthcare框架为医疗机器人的开发提供了全流程支持:
数字原型设计:在虚拟环境中快速设计和迭代机器人的机械结构和控制算法。
合成数据生成:在数字孪生环境中模拟机器人的操作和传感器数据,生成用于AI训练的逼真合成数据。
AI模型验证:在将AI模型部署到物理机器人之前,先在数字孪生中进行充分的测试和验证,模拟各种极端和罕见场景。
从仿真到现实的部署:通过“仿真到现实”(Sim-to-Real)技术,将在虚拟环境中训练好的AI模型无缝迁移到物理设备上。
强生医疗和GE医疗等行业巨头已经开始采用这一范式。例如,强生利用该平台对其MONARCH机器人手术平台进行设计和测试,将原本需要数月甚至数年的验证周期缩短至数小时。这不仅是效率的提升,更是一种研发范式的根本性变革。
4.3 路径三:可信AI与生态合作构建信任桥梁
为了跨越信任的“最后一公里”,技术和生态层面的努力同样至关重要。
提升可解释性:产业界正在积极研究和应用各种可解释AI(XAI)技术,如注意力机制可视化、SHAP值分析等,让模型的决策过程更加透明。NVIDIA Clara平台中的视觉语言模型Reason,就是通过捕捉人类专家的推理过程,来提升医疗AI透明度的一次尝试。
构建开放生态:单一企业无法解决所有问题。通过开放平台、开源社区(如MONAI)和初创加速计划(如NVIDIA Inception),构建一个开放、协作的创新生态,能够汇聚全产业的智慧,共同推动技术标准的建立、最佳实践的分享和可信评测体系的完善。
结论
AI医疗的航船正驶离以影像诊断为代表的“浅水区”,向着更为深邃和广阔的“深水区”进发。英伟达的调研报告为我们清晰地指明了未来的航向,下一站的核心叙事将围绕三大主题展开:以先进影像诊断为代表的临床流程深度整合,以虚拟健康助手为核心的院外服务模式重构,以及以多模态数据融合为基础的个体化精准医疗范式革命。
这条航路并非一帆风顺。数据、工程、信任这三座大山依然横亘在前。然而,破局的路径也已逐渐清晰。以平台化工具链、合成数据与数字孪生为代表的新一代技术范式,正在为产业提供克服这些挑战的强大武器。
最终,真正的机会将属于那些能够将AI技术无缝嵌入真实诊疗路径,构建起从数据、模型到流程、支付的完整商业闭环,并最终为患者和医疗系统创造可衡量、可持续价值的实践者。这场变革的核心,将不再仅仅是算法的比拼,而是对临床场景的深刻理解、对数据治理的敬畏、以及构建可信、可规模化交付系统的工程能力的综合较量。谁能率先打通“数据困境—产品闭环—价值链实现”这三大关隘,谁就将掌握开启AI医疗新周期的钥匙。
📢💻 【省心锐评】
AI医疗正从“工具”进化为“基础设施”。未来竞争的胜负手,不在于模型本身,而在于谁能构建一个数据驱动、流程闭环、价值可信的医疗新生态。

.png)


评论